
近日,欧洲杯竞猜平台基础欧洲杯竞猜平台药理学与化学生物学系高小玲教授联合上海中医药大学陈红专教授和加拿大多伦多大学郑岗教授在国际权威杂志《自然.纳米技术》(Nature Nanotechnology)正式发表了题为“Intracerebral fate of organic and inorganic nanoparticles is dependent on microglial extracellular vesicle function”的研究论文。《自然.纳米技术》同期配发《Intracerebral fate of engineered nanoparticles》新闻和评述。
纳米递药技术的快速发展为疾病诊疗带来了革命性进展,但对脑部疾病的诊疗仍面临巨大挑战。既往研究多聚焦于各种纳米递药系统跨血脑屏障药物递送效率和效应,而对于入脑后纳米递药系统的脑内转运和清除模式(脑内命运)等缺乏了解,极大限制了纳米递药系统的有效安全应用的拓展。一方面,纳米递药系统为药物的高效脑内靶向递送并诊治疾病提供更多机会;另一方面,纳米递药系统本身在脑内的过量蓄积亦可能引起不可逆转的中枢神经系统(CNS)潜在毒副作用。因此,深入探讨纳米递药系统入脑后的命运决定机制及其调控方案将为其安全应用提供重要依据和保障,具有重要的理论价值和现实意义。
高小玲课题组长期聚焦CNS的药物递送研究,特别关注递药技术的高效性和安全性,在国际上率先开展了纳米递药系统的脑内命运和清除机制研究。该研究发现有机材料构成的重组高密度脂蛋白和聚乙二醇-聚乳酸纳米粒可经过胶质淋巴系统途径向脑外快速清除;而金纳米粒、量子点、氧化铁纳米颗粒等无机纳米粒的脑清除过程缓慢,存在脑内蓄积和引发神经毒性的风险。小胶质细胞是CNS常驻巨噬细胞,在清除异物,维持脑内稳态发挥重要作用。小胶质细胞摄取有机纳米粒后,将其转运至血管旁,使其通过胶质淋巴系统向脑外清除;而无机纳米粒被小胶质细胞捕获后,长时间滞留于胞内,无法外排。
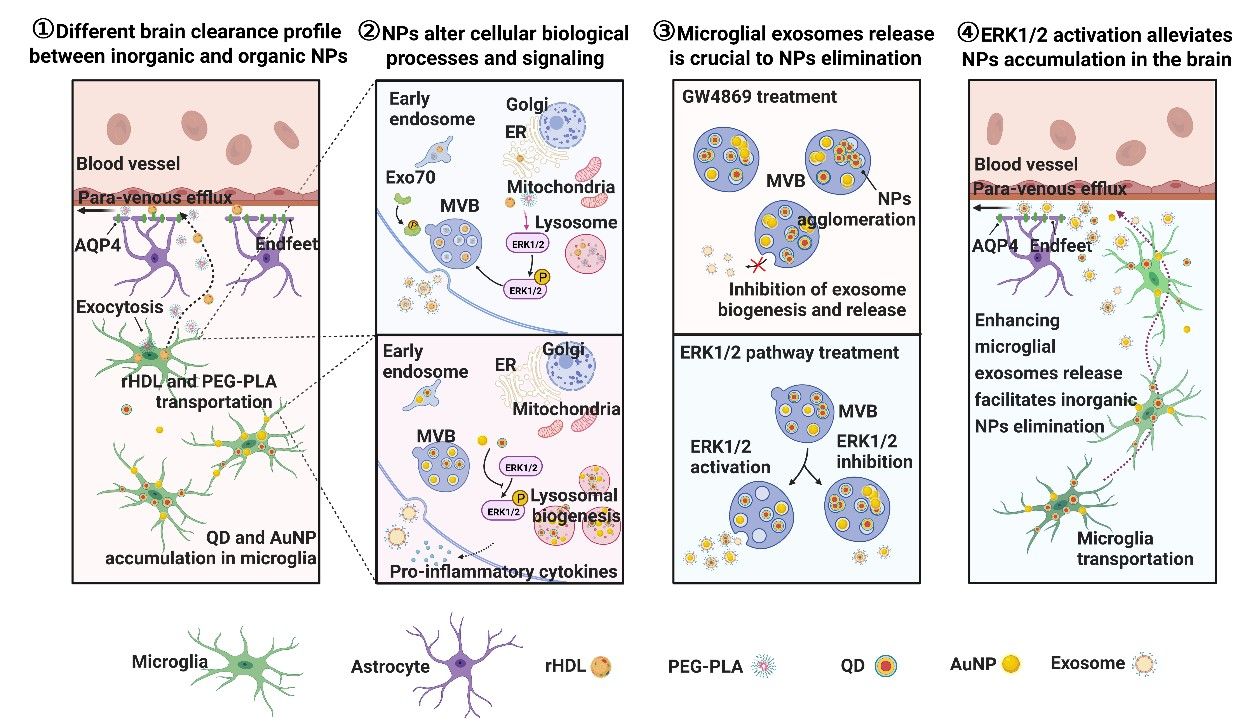
为了揭示小胶质细胞介导不同材料纳米粒脑内转运和清除差异的机制,研究人员分析比较了小胶质细胞内各纳米粒的分布、转运与外排方式,并采用转录组学等系统生物学方法比较各种纳米粒对细胞生物学过程和关键信号通路的影响。发现有机、无机种类纳米粒处理后,小胶质细胞内与胞内囊泡转运、细胞外囊泡(EVs)发生和释放等过程密切相关的细胞外信号调节激酶(ERK1/2)信号通路发生了不同方向的变化:无机纳米粒处理抑制小胶质细胞的ERK1/2通路,EVs分泌减少;而有机纳米粒促进小胶质细胞ERK1/2通路激活,胞内囊泡转运增加,EVs分泌增加。而抑制EVs分泌,显著减少纳米粒从小胶质细胞外排,抑制其脑内转运和清除。以上结果表明,小胶质细胞的EVs分泌可能是其介导纳米粒脑内转运和清除的关键机制,相关途径受ERK1/2信号通路调控。
为实现纳米递药系统的脑内命运调控,研究人员进一步提出通过药理学手段激活ERK1/2通路,促进小胶质细胞以EVs分泌方式促进纳米粒从脑实质转运至血管旁清除,从而减少脑内纳米粒的脑内蓄积。研究发现ERK1/2激动剂帕莫酸处理后,小胶质细胞分泌的EVs数量显著增多,且在EVs伴随包裹大量QD和AuNP。重要的是,在帕莫酸共注射情况下,量子点和金纳米粒的脑清除速率分别提高至原来的5.48倍和28.56倍。小胶质细胞耗竭和胶质淋巴系统抑制实验证实帕莫酸促进的无机纳米粒脑清除同样是通过小胶质细胞介导的胶质淋巴系统途径实现的。
综上所述,该研究通过阐明不同纳米递药系统脑清除差异的原因,揭示小胶质细胞EVs对于脑内纳米粒的清除至关重要;发现通过激活ERK1/2通路,可促进小胶质细胞EVs的释放,有效减轻纳米粒特别是具有神经毒性的无机纳米粒的脑内蓄积。以上发现填补了纳米递药系统的脑内命运调控领域研究的空白,同时为纳米递药系统的脑内安全应用提供了重要的理论和实验基础。
欧洲杯竞猜平台高金超博士为该论文的第一作者,高小玲教授、上海中医药大学陈红专教授和加拿大多伦多大学郑岗教授为共同通讯作者。该工作得到了国家自然科学基金、国家重点研发计划、上海市科委、上海市科委项目的资助。欧洲杯竞猜平台基础医学公共技术平台和欧洲杯竞猜平台分析测试中心提供了重要的设备和技术支持。

